|
COURS DE CHROMATOGRAPHIE
(Master de Chimie 1ère année) Faculté des
Sciences d'Orsay
|
CHROMATOGRAPHIE
EN PHASE GAZEUSE
4-1-
DESCRIPTION DE L'APPAREILLAGE
Figure
4-1: Schéma simplifié du chromatographe en phase
gazeuse
4-2-
PHASES STATIONNAIRES
Les phases les plus
répandues sont les polymères siliconés
dérivés du diméthyl polysiloxane
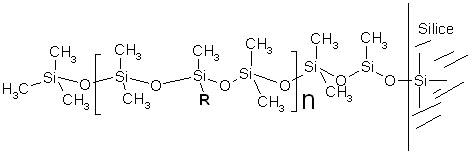 Figure
4-2 : phase stationnaire dérivée du
diméthyl polysiloxane.
Figure
4-2 : phase stationnaire dérivée du
diméthyl polysiloxane.
Suivant le pourcentage de groupement R
par rapport aux groupes CH3,
on peut modifier la polarité de la colonne et donc ses
propriétés en chromatographie
Si R= CH3
, la colonne est complétement apolaire et sépare
les produits suivant leur point d'ébullition (noms
commerciaux : DB-1,
OV101, SE-30...)
Si le % de R=
Phényle
est égal à 5%, on a la colonne la plus
utilisée en CPG, elle est
répertoriée sous
les noms commerciaux suivants:
DB5, CPsil5, OV5...
Si on incorpore un substituant
cyanopropyle
(R=-CH2-CH2-CH2-CN)
la polarité augmente beaucoup (à cause du fort
moment dipolaire du groupe -CN).
Ce sont les phases DB 1701,
CPSil 18...
Ces phases à base de
silicone présentent deux
avantages pour la CPG :
1- une bonne inertie
chimique, elles ne réagissent ni avec
les phases stationnaires, ni avec les produits injectés.
2- une très bonne
tenue à la
température, elles peuvent être
chauffées
sans dommage jusqu'à 300°C
Il existent d'autres phases
beaucoup plus polaires à base de
polyethylène glycol.
HO-(-CH2-CH2-O-)n-O-(Silice)
Elles sont greffées sur les parois en silice de la
colonne par l'intermédiaire d'une liaison Si-O-C
Les dénominations commerciales de ces phases sont: Carbowax,
DB-wax, CP wax 52.
Ces phases sont utilisables entre 20° et 250°C,
elles sont moins inertes que les phases siliconées, elles
sont en
particulier très
sensibles à l'oxygène.
4-3-
PHASES MOBILES
La
phase mobile est un gaz de faible viscosité, trois gaz
sont exclusivement employés, l'azote,
l'hydrogène et l'hélium.
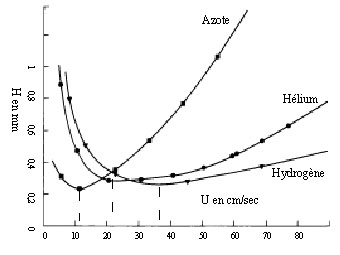 Figure
4-3 Courbes
de Van Deemter pour l'azote, l'hélium et
l'hydrogène
Figure
4-3 Courbes
de Van Deemter pour l'azote, l'hélium et
l'hydrogène
Pour ces raisons de sécurité, c'est
l'hélium qui en général
utilisé.
4-4-
LES COLONNES
Ils
existent 2 catégories de colonnes en CPG, les colonnes
remplies et les colonnes capillaires.
4-4-1-
Colonnes remplies.
Les colonnes les plus
répandues sont en acier inox ou en
verre, leur longueur standard est de 3
m, leur
diamètre intérieur étant compris
entre 10 et 4
mm.
Ces colonnes sont remplies d'un support inerte
imprégné
d'une phase stationnaire, le diamètre des particules est
entre 100 et 200 mm.
Le taux d'imprégnation des phases
stationnaires varie entre 1 et 10% en masse. Ces colonnes sont
maintenant très peu
employées.
4-4-2-
Colonnes capillaires
Les colonnes standard sont en
quartz fondu (silice très
pure) et entourées d'une gaine de polymère souple,
ce qui leur
confère une grande
résistance à la torsion
Elles ont entre 10 et 100
m de long et
leur diamètre intérieur est
entre 0,10 ou 0,70
mm.
La
phase
stationnaire est greffée sur les parois de la colonne,
l'épaisseur de phase
stationnaire varie entre 0,10 mm
et 5 mm.
Les colonnes les plus répandues sont du type WCOT (Wall
Coated upon Tubular Column)
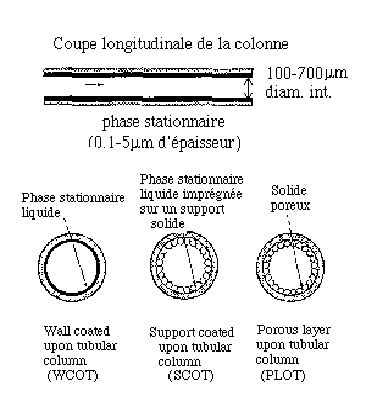 Figure
4-3 Différents
type de colonnes capillaires
Figure
4-3 Différents
type de colonnes capillaires
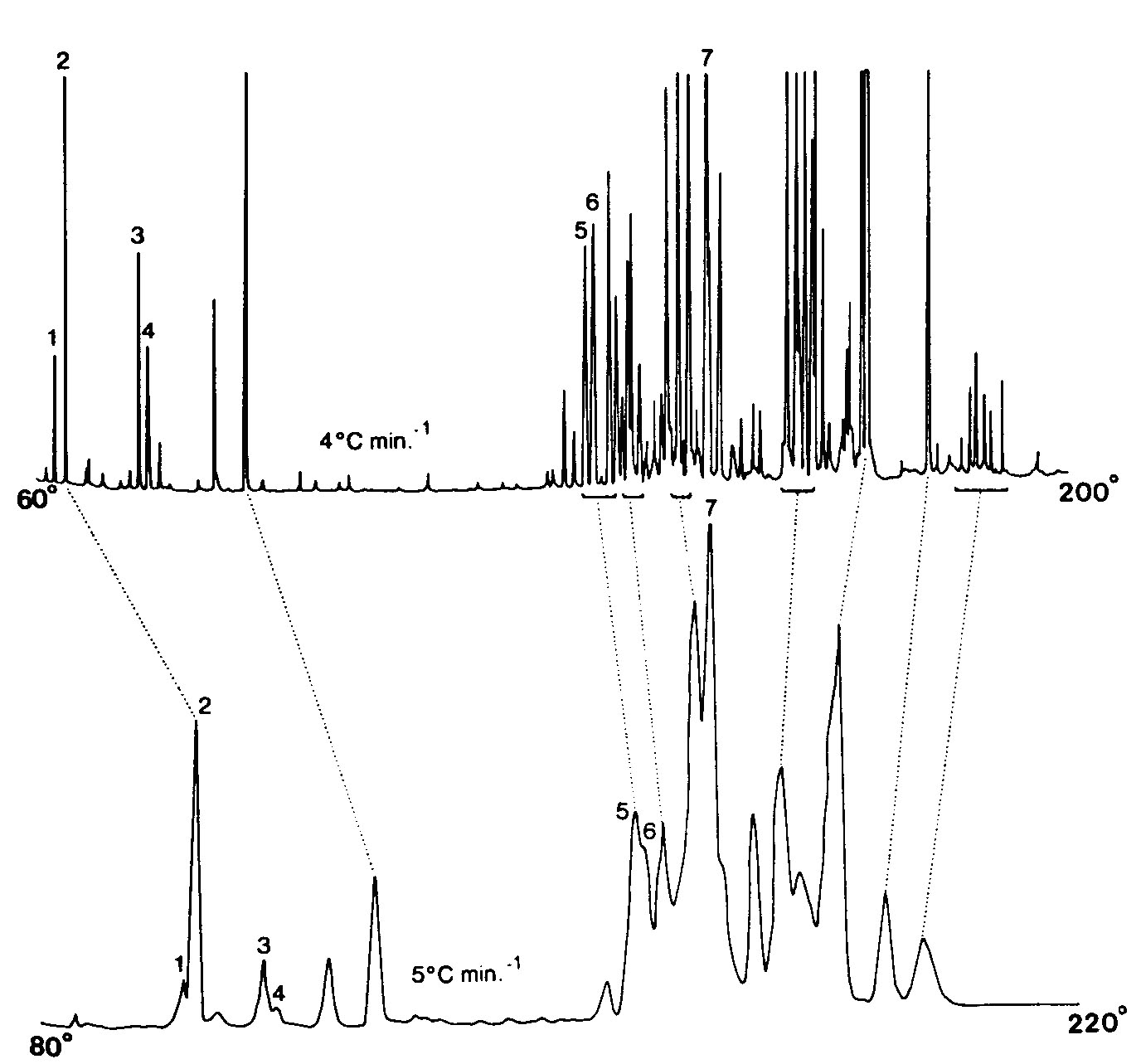
Figure
4-4.
Chromatogrammes de l'huile
"d'iris des marais" obtenus (en
haut) sur une colonne capillaire de 50
m et (en bas)
sur une colonne remplie de 4m.
4-4-3-
Calcul du rapport de phase b
des
colonnes capillaires
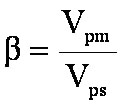 correspond au rapport du volume de la phase mobile sur la phase
stationnaire. Il apparait dans la formule
correspond au rapport du volume de la phase mobile sur la phase
stationnaire. Il apparait dans la formule 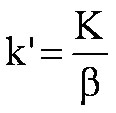 (eq. 1-7)
(eq. 1-7)
Le
volume de la phase mobile est égal à
Vpm
= 2
pr2L
(où
L
est la longueur de la colonne)
Le volume de la phase stationnaire est égal au volume de la
couronne d'épaisseur
e
soit
Vps
= 2
prLe
. On obtient donc pour le
rapport de phase :
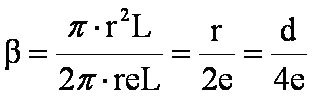
(eq. 4-1) et par
conséquent :
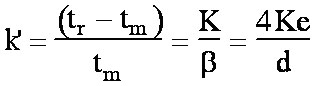
(eq. 4-2)
et
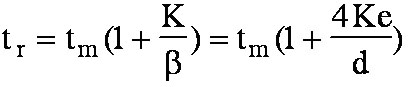
(eq(4-3)
D'après l'eq. 4-3, on
peut déduire que le temps d'analyse
(tr)
augmente si :
- le
diamètre intérieur de la colonne capillaire (d)
diminue
-
l'épaisseur du film de phase stationnaire (e)
augmente.
En outre s'il n'y a aucune affinité entre un produit et la
phase stationnaire soit K=0,
on a
tr =
tm , ce qui est le cas de
l'air ou en première approximation du méthane.
On peut déduire de
l'eq. 4-2 que :
-
pour bien
analyser une substance volatile, il faut augmenter k',
donc diminuer le
diamètre (d)
de la colonne et (ou) augmenter
l'épaisseur du film de phase
stationnaire (e).
- pour bien
analyser une substance peu volatile, il faut diminuer k',
donc
augmenter le
diamètre (d)
de la colonne et (ou) diminuer
l'épaisseur du film de phase
stationnaire (e).
4-4-4-
Exercice d'application
L’analyse
CPG des
arômes contenus dans une barre chocolatée
se fait dans les conditions suivantes :
4g
"peppermint/chocolate cookie bar "
Prélèvement
par espace de tête
Colonne CPG: PTE-5; 30m x 0,25mm ID; 0,25µm
film
Four: 60°C
(1 min) jusqu’à 230°C
à 10°C/min
phase mobile: helium, 35cm/sec
Det.: FID, 250°C
Inj.: splitless (split fermé 3 min), 250°C
Questions
1- Calculer le temps mort de cette analyse
2- Calculer le rapport de phase de la colonne
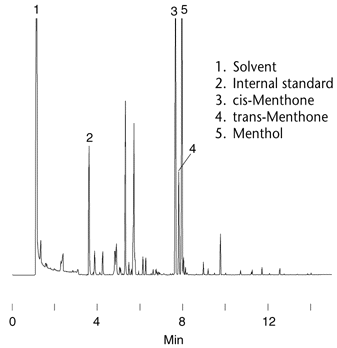
3- Le
menthol sortant à 7,80 mn, calculer sa constante de
partition K dans cette
analyse. |
|
Solution.
1- tm = L/u = 3000/35 = 85,71 sec = 1,43 mn.
2- b
=
d/4e = 0,25/4*0,25*10-3 = 250
3- K = k’* b
=
[(tr-tm)/tm]*b
= 1113 (donc très supérieur à
1) et DG°
=
-RTln(K) est <0, car le processus de dissolution du
soluté dans la phase
mobile est spontané.
4-5-
LES INJECTEURS
L'injecteur
standard (95% des appareil en sont équipés) d'un
chromatographe avec colonne capillaire est du type "split/splitless".
C'est à dire que l'on peut ajuster la quantité de
produit passant dans la
colonne par rapport à la quantité
injectée dans le chromatographe. Cet
ajustement se fait à l'aide d'une vanne.
Si on injecte un microlitre de produit (1 ml)
et que seulement 0,01 ml
rentre dans la colonne, on a un
"split" de 100 et 0,99 ml
de la solution a été
évacué à l'extérieur via la
vanne de "split".
En revanche, si l'on
dispose d'un produit très minoritaire
ou très dilué dans un solvant, on peut choisir de
l'injecter en mode
"splitless", dans ce cas tout le produit injecté se retrouve
dans la
colonne. Il faut dans ce cas baisser la température du four
vers 20-30°C
sous la température
d'ébullition du solvant et dans certain cas couper ou
déconnecter le détecteur
pendant l'élution du solvant.
http://www.shsu.edu/%7Echm_tgc/sounds/GC.mov
Ils
existent d'autres types d'injecteur ("on
column", "headspace"..etc.)
|
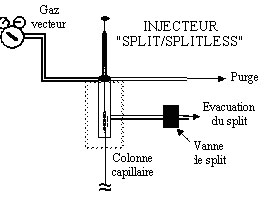
Figure 4-5 Principe d'un injecteur "split-splitless"
|
4-6-
LE FOUR
Cette partie de l'équipement doit pouvoir fonctionner
suivant deux modes
-
isotherme
entre 20 et 400°C
- en
programmation de température avec des séquences
plus ou
moins complexes.
4-7-
LE
DÉTECTEUR
|
4-7-1
Détecteur à ionisation à flamme
Un
des détecteurs le plus
répandu est le détecteur par ionisation
à flamme
(en anglais: FID). Les effluents à la sortie de la colonne
sont
brûlés dans une
flamme alimentée par un mélange
hydrogène-air. La
combustion des composés
organiques produit des ions qui sont collectés par une
électrode entourant la
flamme. Ce courant de flamme est amplifié par un
électromètre qui transforme
le courant en tension puis cette
tension est dirigée sur un enregistreur.
Ce
détecteur est très
sensible, car il donne un signal pour
environ 2 pg de produit. Il est linéaire. En revanche, il
est
discriminant, sa
réponse varie suivant les produits injectés, ce
qui
impose un étalonnage si on
veut analyser un mélange.
Le
détecteur à ionisation de
flamme ne donne aucune réponse
avec les gaz les composés inorganiques et des corps
très
simples comme H2O,
NH3,
CO2,
H2C=O....
http://www.shsu.edu/%7Echm_tgc/sounds/FID.mov
|
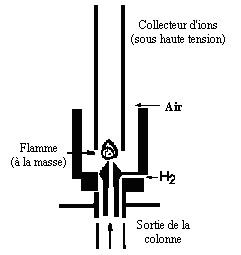
Figure
4-6: Principe du
détecteur FID
|
4-7-2-
Autres détecteurs
D'autres
détecteurs ont été mis au point, mais
ils sont
spécifiques, c'est à dire qu'ils ont une
très grande sensibilité pour des
catégories de produits. Par exemple, le détecteur
à capture d'électron est
utilisé pour les dérivés
halogénés, nitrés et les produits
présentant des
groupements électronégatifs.
Type
du détecteur (abréviation
anglaise)
|
Sélectivité,
produits détectés
|
Sensibilité
|
Ionisation
à flamme (FID)
|
La
plupart des produits organiques
|
10-10
g
|
Conductibilité
thermique (TCD)
|
Universel |
10-8
g
|
Capture
d'électrons (ECD)
|
Produits
halogénés, organométalliques |
10-13g
|
| Thermo-ionisation
(TID) |
Produits
azotés ou phosphorés |
10-11
g
|
| Photo-ionisation
(PID) |
Produits
oxygénés, soufrés,
organométalliques… |
10-12
g |
| Photométrique
(FPD) |
Soufrés,
phosphorés, organométalliques… |
10-10
g |
|
Spectromètre
de masse (GC-MS)
|
Universel |
10-10
g - 10-16
g |
Le détecteur
à conductibilité thermique est
linéaire et non
discriminant mais moins sensible que le détecteur
à ionisation de flamme.
Un spectromètre de masse équipe 30% des
chromatographes en
phase gazeuse, cette proportion croît à cause de
l'extrême sensibilité de ce
détecteur et au fait que l'obtention du spectre de masse
permet
l’identification des produits.
http://www.shsu.edu/~chemistry/primers/gcms.html
4-8
CHROMATOGRAPHIE GAZ-SOLIDE
Dans ce cas, la phase
stationnaire est un polymère poreux
(ex: Porapak) ou une substance adsorbante telle que l'alumine ou un
tamis
moléculaire. Cette chromatographie permet la
séparation des produits
légers et en particulier des gaz.
Les colonnes peuvent
être remplies ou
capillaires. Une meilleure séparation est obtenue avec une
colonne capillaire,
dans ce
cas les adsorbants sont
collés
sur les parois de la colonne.
Ce sont les colonnes
PLOT ("porous layer open
tubular"= tubulaire ouverte à couche
poreuse) Cf; Figure 4-3
4-9
REFERENCES
http://www.shu.ac.uk/schools/sci/chem/tutorials/chrom/gaschrm.htm
http://ull.chemistry.uakron.edu/chemsep/gc/
http://www.chem.vt.edu/chem-ed/sep/gc/gc.html
http://www.ionsource.com/tutorial/capillary/captoc.htm
http://www.sigmaaldrich.com/Graphics/Supelco/objects/6800/6732.pdf


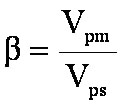 correspond au rapport du volume de la phase mobile sur la phase
stationnaire. Il apparait dans la formule
correspond au rapport du volume de la phase mobile sur la phase
stationnaire. Il apparait dans la formule 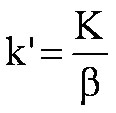 (eq. 1-7)
(eq. 1-7)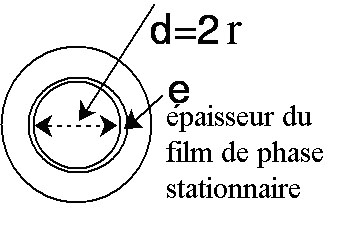
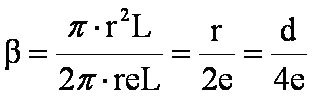 (eq. 4-1) et par
conséquent :
(eq. 4-1) et par
conséquent :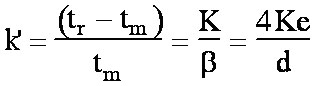 (eq. 4-2)
et
(eq. 4-2)
et 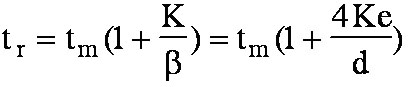 (eq(4-3)
(eq(4-3)