|
COURS DE CHROMATOGRAPHIE
(Master de Chimie 1ère année) Faculté des
Sciences d'Orsay
- Généralités
sur la chromatographie
- Théorie de la chromatographie 1 - Théorie de la chromatographie 2 - Théorie de la chromatographie 3 - Facteur de
séparation de deux pics
- La
chromatographie en phase gazeuse (CPG)- Facteur de résolution de deux pics - Exercice d'application - Annexe : démonstration de la formule de Purnell - Analyse en chromatographie en phase gazeuse - Optimisation d'une analyse - Glossaire |
3-1-1 Définition du facteur de séparation.
Le chromatogramme suivant montre la séparation de 2 solutés A et B.
Figure 3-1.
Chromatogramme d'un mélange de 2
produits A et B sur une colonne CPG remplie de
On
appelle le facteur de séparation (ou
sélectivité) le terme suivant: :
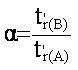 (eq.3-1)
(eq.3-1)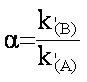 (eq.3-2)
(eq.3-2)
3-1-2 Interprétation thermodynamique du facteur de séparation.
En utilisant (eq.2-9), on peut exprimer le facteur de séparation a en fonction des coefficients de partition (ou constantes d'équilibre K) des solutés A et B :
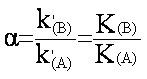 (eq.3-3)
(eq.3-3)
L'expression (eq.2-10) permet d'obtenir le facteur de séparation en fonction de la température:
RT
ln a = -( G°(B)
-
G°(B)
-  G°(A))
(eq.3-4)
G°(A))
(eq.3-4)
Le terme a traduit donc la différence d'énergie libre de dissolution des solutés A et B. Comme a est très voisin de 1, on peut souvent utiliser l'expression simplifiée (eq.3-5):
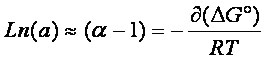 (eq.3-5)
(eq.3-5)3-2 – FACTEUR DE RÉSOLUTION DE DEUX PICS
3-2-1 Définition du facteur de résolution.
Par convention le facteur de résolution R des 2 pics A et B de la figure 2-1, s'écrit :
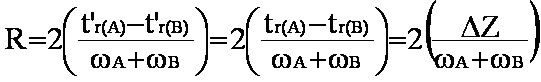 (eq.3-6)
(eq.3-6)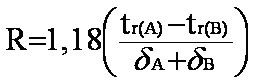 (eq.3-7)
(eq.3-7)
Contrairement à a le terme R prend en compte la forme des pics et leur recouvrement éventuel.
La figure 3-2 montre l'influence de la résolution R sur la séparation de 2 pics de même intensité. Pour une résolution inférieure à 0.6 les pics ne sont pas séparés.
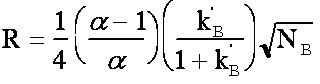 (éq.3-8)
(éq.3-8)3-2-2 Annexe: Démonstration de la formule de Purnell.
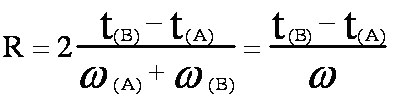 car
wA ≈
wB
= w
et
en posant
t(A)
=tr(A)
et
t(B)
=tr(B)
car
wA ≈
wB
= w
et
en posant
t(A)
=tr(A)
et
t(B)
=tr(B)
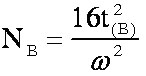 d'où
d'où 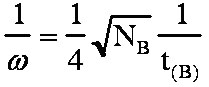 et
et 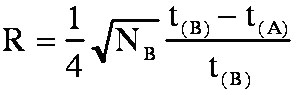 comme
t(B)
=tr(B)
= tm(1+k'B)
comme
t(B)
=tr(B)
= tm(1+k'B)
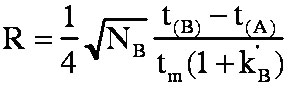 en
multipliant par
en
multipliant par
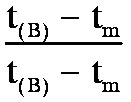 on
obtient :
on
obtient :
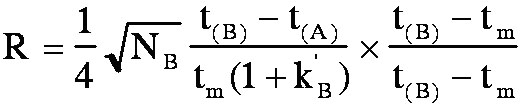 d'où
d'où
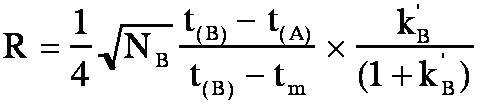
Or
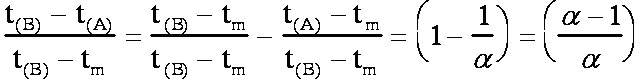
D'où
finalement la formule de Purnell:
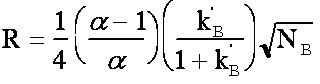 (éq.3-8)
(éq.3-8)
|
Sur une colonne HPLC (phase stationnaire : C18), 15cm x 4,6mm, remplie de particules de 5mm, avec l’acétonitrile (CH3CN) comme phase mobile et à une température de 30°C, on mesure un temps mort de 1,07 mn. Dans ces conditions, on obtient Amphétamine (A) : temps de rétention = 2,40 min, largeur du pic à mi-hauteur d = 5 sec. Methamphétamine (M) : temps de rétention = 2,85 min, largeur du pic à mi-hauteur d = 6 sec.
1- Calculez le facteur de séparation a 2-
Calculez le facteur de résolution R 3-
Évaluez le nombre de plateau théorique de la
colonne N  (G) entre
ces 2 produits dans la phase
stationnaire (R = 8,31 J K-1 mol-1) (G) entre
ces 2 produits dans la phase
stationnaire (R = 8,31 J K-1 mol-1)
|
Solutions:
1- k'(A) = 1,243 et k'(M) = 1,664 d'où a = 1,338.
2- R= 1,118
3- N= 5390 plateaux théoriques d'après Purnell
4-
d (G)
= -RTln(a)
= -733 J /mol
(G)
= -RTln(a)
= -733 J /mol