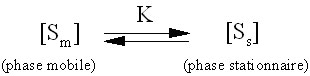|
COURS DE CHROMATOGRAPHIE
(Master de Chimie 1ère année) Faculté des
Sciences d'Orsay
|
GÉNÉRALITÉS
LA CHROMATOGRAPHIE
0-1
HISTORIQUE DE LA CHROMATOGRAPHIE
En 1906 un chimiste russe,
Tswett, a
séparé des pigments
végétaux colorés sur une colonne
remplie de carbonate de
calcium pulvérulent, les pigments étaient
entraînés avec de l'éther de
pétrole
(mélange pentanes et d’hexanes). Il a observé sur
la
colonne la formation de
bandes de couleur différente
(vert, orange, jaune..). Il a donné à
cette
technique le nom de chromatographie
(écriture des couleurs). Il a défini
également les termes : chromatogramme,
élution, rétention.
Cette technique
fut quasi-abandonnée jusqu'en 1930, où Edgar
Lederer a purifié
par la méthode de Tswett la
lutéine du
jaune d’œuf.
Vers
1940, Martin et Synge développent la
pratique et la théorie de la chromatographie, ils
obtiennent le prix Nobel en 1952
En
1952, mise
au point de la
Chromatographie en Phase Gazeuse (CPG).
En
1968, mise
au point de la
Chromatographie Liquide Haute Performance CLHP ou HPLC en anglais.
En
1979,
première
séparation chirale par HPLC.
0-2
PRINCIPES DE LA CHROMATOGRAPHIE.
La chromatographie
est une méthode basée
sur la différence de miscibilité d'un
soluté entre
deux
phases. Cette méthode s'apparente à l'extraction.
|
Le
principe de l'extraction est simple :
Soit
un soluté S
réparti entre 2 phases non
miscibles (1) et (2).
A
l'équilibre, on a
:
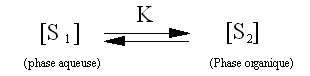
avec
la constante d'équilibre K
= [S2]/[S1]
,
K
s'appelle aussi le coefficient de partition.
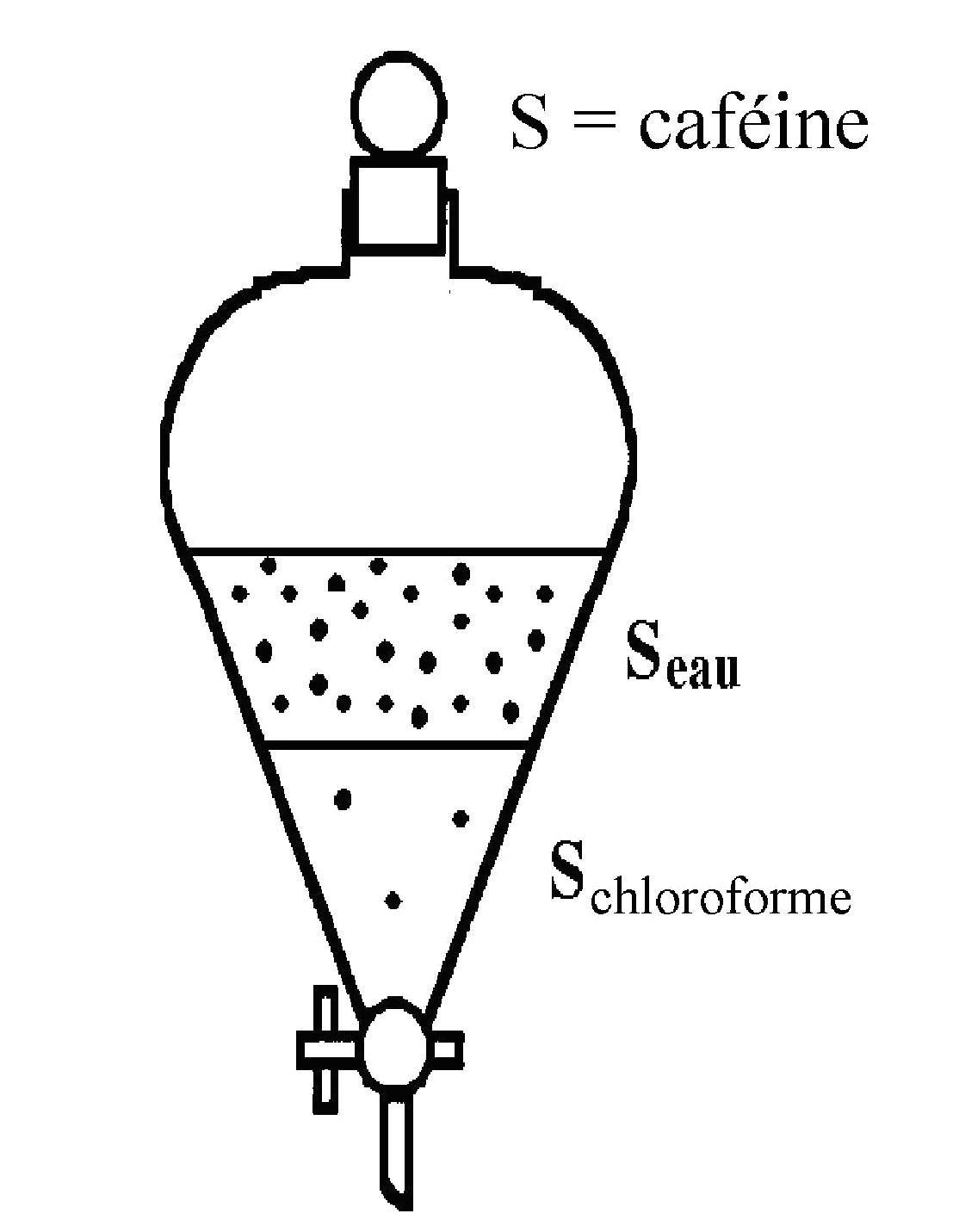
Application:
extraction de la caféine avec
du chloroforme dans une décoction de thé.
K =
[caféine(CHCl3)]/[caféine(eau)]
= 8,36.
En
une extraction on extrait 90% de caféine du
thé, après 2 extractions 99% de la
caféine sera isolée.
|
|
Comme
l'extraction la chromatographie est une méthode
basée sur la différence de solvatation d'un
soluté S
entre deux phases.
1- une phase mobile
(pm)
qui
est un fluide qui traverse la colonne
(pour
Tswett = éther de pétrole.)
2- une phase stationnaire (ps) qui est une
substance fixée sur la colonne
(pour
Tswett = carbonate de calcium.)
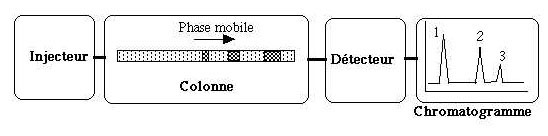 Figure
2 Schéma simplifié de la chromatographie
Figure
2 Schéma simplifié de la chromatographie
Avec
l'équilibre suivant :
On a toujours [Spm]<<
[Sps],
d'où
K>> 1
suivant la valeur de K
le produit sera plus ou moins
retenu sur la colonne, il sera "élué" plus ou
moins rapidement.
Les répartitions
différentes des
solutés entre la
phase mobile et la
phase stationnaire viennent d'adsorptions
différentiées des produits.
A l'origine
de ces phénomènes d'adsorption, il a des
paramètres physiques (taille des
particules, porosité, surface spécifique...) et
des paramètres chimiques
(
interactions intermoléculaires comme les liaisons
hydrogène, liaisons de Van
der Waals...).
0-3-
DIFFÉRENTS TYPES DE CHROMATOGRAPHIE EN PHASE LIQUIDE
Suivant
les
propriétés physiques et chimiques du
soluté S,
plusieurs types de
chromatographies peuvent être utilisées.
0-3-1
Chromatographie en phase liquide (LC)
C'est
la
chromatographie la plus ancienne, où la phase mobile est un
liquide (pm
=
liquide).
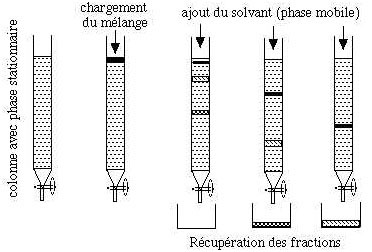
Figure
4 Schéma simplifié d'une chromatographie liquide
|
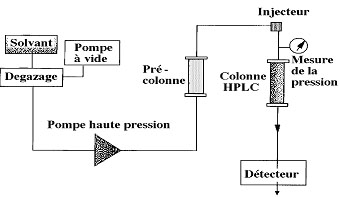
Figure
3 Schéma
simplifié d'un chromatographe HPLC
|
La
Chromatographie
Liquide Haute Performance (CLHP ou HPLC en anglais) est une
amélioration de la
chromatographie en phase liquide, dans laquelle la phase mobile est
utilisée
sous haute pression. L'utilisation de la haute
pression améliore l'efficacité des
séparations et réduit fortement les temps
d'analyse.
0-3-2
Chromatographie
liquide-solide (phase
normale
)
pm
= solvant
peu polaire ( pentane, acétate d'éthyle,
éther, dichlorométhane...méthanol)
ps
= gel de
silice ou d'alumine
Les
interactions sont des
interactions électrostatiques du type dipôle-dipôle
ou dipôle-dipôle induit (Si-O-Si-O-H
----- X )
Les solutés
sont élués dans l'ordre de polarité
croissante (par exemple carbure, puis cétone enfin
alcool)
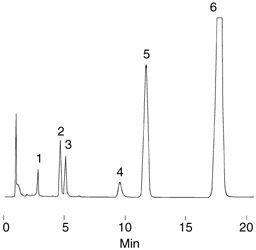
Figure
4 : HPLC
liquide-solide (phase normale)
|
Séparation
des vitamines lipidiques
Conditions
Column:
SUPELCOSIL
LC-Si, 15cm x 4.6mm ID, 5µm particles
Phase mobile : hexane/ alcool amylique (99.65:0.35)
débit: 2mL/min
Det.: UV, 280nm
Inj.: 20µL
Résultats
1. a-Tocopherol,
2. b-Tocopherol
3. g-Tocopherol,
4. d-Tocopherol
5. Ergocalciferol 6.
Retinol
|
0-3-3
Chromatographie
liquide-liquide (phase inverse)
pm
= solvants
polaires (eau- méthanol - acétonitrile)
ps
=
liquide greffé sur un gel de silice, on peut greffer de
longues
chaînes
aliphatiques
pour obtenir par exemple le motif Si-O-Si-O-C
17H
34-CH
3,
(ps C18)
ou des chaînes avec des substituants aromatiques
.
La phase stationnaire
est dans ce cas assimilée à un liquide
immobilisé
sur la colonne.
Les
interactions sont des
interactions du type
lipidique
(interactions avec de longues chaines hydrocarbonées)
Les
solutés sont élués dans l'ordre de
polarité décroissante
(par exemple alcool,
puis
cétone enfin carbure) , à l'inverse de la
chromatographie
solide-liquide
Figure
5: HPLC
liquide-liquide (phase inverse).
|
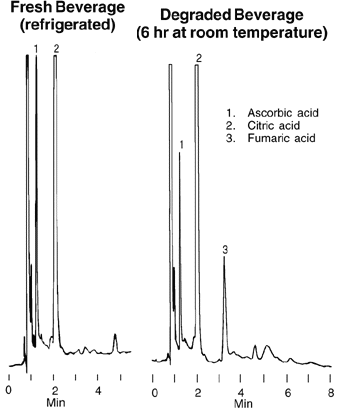
Dosage
des acides organiques
dans le jus d'orange.
Conditions
SUPELCOSIL
15cm x 4.6mm, particules de
5µm (avec
filtre de 0,5µm avant
la colonne)
Phase Mobile: eau à
pH 2.0
Débit:
2mL/min
Det.: UV,
210nm
Inj.:
5µL jus d’orange
Résultats
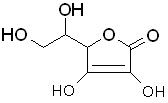
-
Acide fumarique
HO-CO-CH=CH-COOH
(E)
- Acide
citrique
HO-CO-CH(OH)(CH2-COOH)2
-
Acide
ascorbique
|
0-3-4
Chromatographie
sur couche mince (CCM
ou TLC en anglais)
ps
= gel de
silice ou d'alumine, réparti en couche mince (0,2mm) sur
une plaque.
pm=
mêmes solvants qu'en
phase
inverse ou normale, même principe que
précédemment
mais pour des quantités
faibles de produit. Chaque
produit est caractérisé par la constante Rf
(Retardation
factor) :
Rf = Hp/Hs,
où Hp =hauteur
d'élution du produit
et Hs =
hauteur d'élution du solvant
Application
: test analytique en fin de
manipulation.
http://www.chem.vt.edu/chem-ed/sep/tlc/tlc.html
0-3-5
Chromatographie
ionique (IEC
en anglais)
pm
= solution
tampon aqueuse.
ps
= résine
échangeuse d'ion , donc un solide comportant des sites
ioniques.
La séparation
est basée sur des interactions ioniques et s'applique
à
des solutés eux même
ionisés (sels..)
Applications : Dosage
des anions
et cations dans une eau
Figure
6. Chromatographie par
échange d’ions.
|
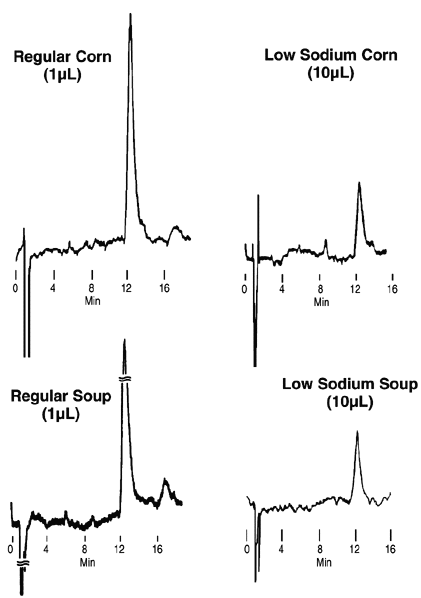
Dosage
du sodium dans des produits alimentaires
(maïs
et
soupes en boite)
Conditions
SUPELCOSIL
LC-SCX, 25cm x 4,6mm ;
particules de 5µm
Température: 35°C
Phase mobile:
eau avec 0,05M acide citrique, pH 2,4
Débit:
2,0mL/min
Detecteur: conductivité
Injecteur:
échantillons de maïs et soupes en boite
dilués (1:1)
avec la phase mobile |
0-3-6
Chromatographie
d'exclusion
stérique (SEC
en
anglais)
Cette
chromatographie est appelée aussi
chromatographie par
perméation sur gel
(GPC)
pm
= solvant organique (en
général tetrahydrofuranne, ou
toluène)
ps
= solide
poreux.
Il y a une
relation entre la taille des pores et la taille des
molécules.
Par exemple
des molécules entre 1000 et 8000 Daltons sont retenues par
des
pores 4 nm, des
molécules entre 200000 et 150000 Daltons sont retenues par
des
pores 250 nm.
Les molécules
plus grosses que la taille des pores sont éluées
les plus
rapidement.
Applications :
Séparation et
dosage des
polymères.
|
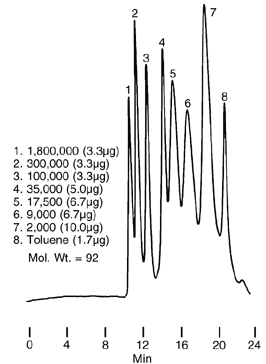
Figure
7 :
HPLC par exclusion stérique d'un mélange de
polystyrènes
Conditions
2 colonnes en série:
SUPELCOSIL LC-1, 25cm x 6.2mm ID,
particules de 5µm
puis SUPELCOSIL LC-301, 25cm x 6.2mm ID, particules de 5µm,
pores
de 300Å
Phase mobile: tetrahydrofuranne
Débit: 1mL/min
Temp.: 45°C
Det.: UV, 254nm
Inj.: 10µL de polymères
Résultats
1. Polystyrène (M. 1 800 000) 3.3µg
2. Polystyrène (M. 300 000)
3.3µg
3. Polystyrène (M. 100 000)
3.3µg
4. Polystyrène (M. 35 000)
5.0µg
5. Polystyrène (M. 17 500)
6.7µg
6. Polystyrène (M. 9 000)
6.7µg
7. Polystyrène (M. 2 000)
10.0µg
8. Toluène 1.7µg
|
0-4-
DIFFÉRENTS TYPES DE CHROMATOGRAPHIE EN PHASE GAZEUSE
Cette chromatographie (CPG ou GC en anglais), qui est
la plus performante au point de vue de la séparation, est
réservée aux produits
volatils et thermostables.
(Masse moléculaire
< 500 Daltons)
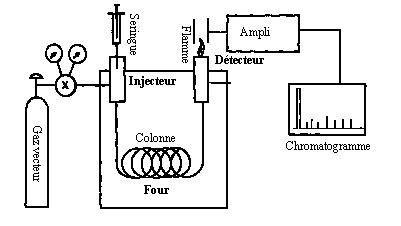
Figure
8. schéma
simplifié d'un chromatographe en phase gazeuse
0-4-1
Chromatographie
gaz-liquide
pm
= gaz
(He, H2,
N2...)
ps
=
liquide greffé sur des particules (colonnes remplies)
ps
=
liquide greffé sur la paroi interne de la colonne (colonnes
capillaires)
La substance greffée sur la colonne est en
général
un polymère siliconé, inerte chimiquement et
tenant bien
la température.
Cette chromatographie est la plus répandue et est
utilisée dans de nombreux domaines (Cf. Analyse en CPG)
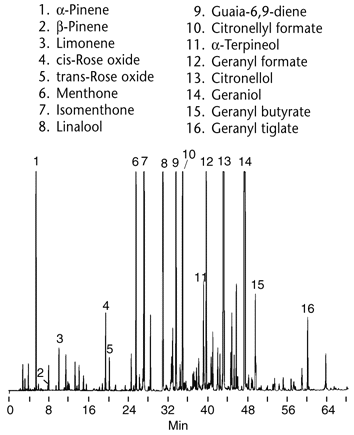
|
Figure
9 Chromatogramme de l'essence de géranium
Conditions
Colonne:
SUPELCOWAX 10, 30m x
0.25mm ID,
film de 0.25µm
Four: 50°C
(2 min) to 280°C
at 2°C/min, puis 20 min
Phase mobile : helium, 25cm/sec
Det.: FID
Inj.: 0.2µL, split (100:1) |
0-4-2
Chromatographie
gaz-solide
pm
= gaz
(He, H2,
N2...)
ps
= solide adsorbant
Ce
type de chromatographie s'applique aux molécules
très
volatiles (gaz, hydrocarbures légers...)
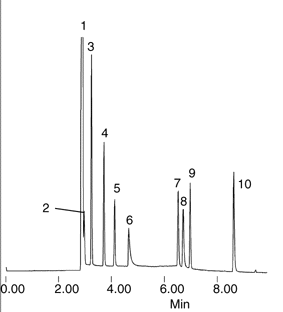
|
Figure
1-14 : Chromatographie
gaz-solide :
Séparation de produits gazeux.
Conditions
Colonne: Supel-Q PLOT, 30m x
0.53mm ID
Four: 35°C
(3 min) to 250°C
at 16°C/min
Phase mobile: helium, 3mL/min
Det.: TCD, 250°C
Inj.: 0,1µL
Résultats
1. Azote (excés)
2. Methane
3. Carbon dioxide
4. Acetylene/Ethylene
5. Ethane
6. Eau
7. Propyne
8. Propylene
9. Propane
10. n-Butane
|
0-5-
AUTRES TYPES DE CHROMATOGRAPHIE
Il existe d'autres types de chromatographie, parmi elles :
La
chromatographie
supercritique
pm
= gaz à
l'état supercritique (en général CO2
à
50° et 150 bars)
ps
= solide
ou liquide greffé sur solide.
Cette
chromatographie combine les bons résultats de la
CPG au point de vue
séparation et le domaine d'utilisation
de la LC.
L'électrophorèse
pm
=
solution tampon.
ps
= gel
disposé sur une plaque ou dans un tube capillaire
Un champ
électrique est appliqué aux deux
extrémités
de la plaque (ou du tube).
Cette
chromatographie est basée sur les différences de
mobilité des ions dans un
champ électrique. Cette mobilité varie en
fonction de la
charge de la taille et
de la géométrie des molécules.
Les ions
positifs vont vers l'électrode négative et vice
versa.
Pour des raisons de
sécurité, une électrode est mise
à la masse
et l'autre est mise à une haute
tension positive ou négative
Applications
: Séparation des
protéines, peptides, empreintes
génétiques.
http://www.shsu.edu/%7Echm_tgc/sounds/GE.mov
http://www.rit.edu/~pac8612/electro/Electro_Sim.html