|
COURS DE CHROMATOGRAPHIE
(Master de Chimie 1ère année) Faculté des
Sciences d'Orsay
|
ANALYSES
EN CHROMATOGRAPHIE EN PHASE GAZEUSE
5-1
PROGRAMMATION DE TEMPÉRATURE EN CPG.
Figure
5-1 Intérêt de la
programmation de température.
Cette
figure 5-1 reproduit deux chromatogrammes d'un mélange
d'alcanes
linéaires C10-C18, avec deux modes de fonctionnement
différents du four du
chromatographe
1-
chromatogramme de gauche: mode isotherme, les produits
légers ne
sont pas séparés et les produits lourds
"traînent"
sur la colonne
2-
chromatogramme de droite: mode en programmation de
température, tous les produits sont
séparés.
Pratiquement
dans une programmation de température, la
température finale doit être juste en
dessous du point d'ébullition du soluté le moins
volatil
5-2 ANALYSE QUALITATIVE
5-2-1
Méthode par exaltation des pics
La
chromatographie en phase gazeuse peut permettre
l'identification d'un produit dans un mélange complexe. A
cette fin on utilise
le temps de rétention (tr).
Dans
un mélange complexe on injecte un produit pur, cela
permet de déterminer le temps de rétention de ce
produit en comparant le
chromatogramme obtenu avec celui du mélange seul.
Cette
méthode est utilisée en répression des
fraudes
(produits alimentaires...), on contrôle la
présence du produit par une autre
injection sur une autre colonne avec une phase stationnaire
différente.
5-2.2-
Méthode des indices de rétention
Les
indices de rétention ont été
définis par Kowats en 1958.
A chaque
produit (i)
est associé un indice de rétention I(i), cet
indice déduit des formules (5-1 et 5-2)
est basé sur un système d'étalonnage
par des hydrocarbures linéaires.
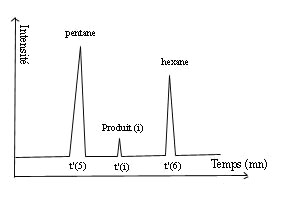
Les
indices I(i) se calculent de 2 manières
différentes suivant le fonctionnement
en température du chromatographe.
En mode isotherme, on injecte
sur la colonne à une température et à
une
pression d'entrée données, les alcanes
linéaires de formule CnH2n+2
avec n ≥ 5.
On repère les temps de rétention
réduits de ces alcanes t'r(n)
et
t'r(n+1)
et
celui du produit considéré t'r(i)
Si un soluté est élué entre les deux
alcanes (n) et (n+1),
son indice de rétention Ii est donné par la
formule suivante:
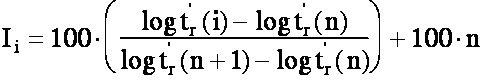
(eq.5-1)
Dans la formule (éq.5-1), on peut employer
indifféremment des logarithmes
népériens ou des logarithmes décimaux
En mode programmation de température la formule est
différente et utilise des temps de rétention
"normaux"
tr(i)
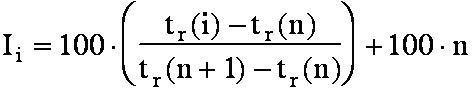
(eq.
5-2)
Il
résulte des formules.5-1 et 5-2 que les alcanes
linéaires on des
indices multiples de 100, I(pentane) = 500, I(hexane) =600...
Ces indices de
rétention se sont avérés
remarquablement
reproductibles
- pour une
phase stationnaire donnée, quelque soit le %
d'imprégnation pour les colonnes
remplies ou l'épaisseur du film pour les colonnes
capillaires.
- ils sont
relativement indépendants de la température.
Cette bonne reproductibilité a été
évaluée à + ou -
0,5%, ceci permet de comparer et d'utiliser des résultats
venant de
laboratoires différents. Ils existent donc des tables
répertoriant les indices de
rétention de nombreux produits chimiques.
"La bonne pratique du laboratoire de
chromatographie" dit que un produit inconnu peut être
identifié si l'on
obtient une bonne coïncidence pour deux phases stationnaires
différentes entre
les indices de rétention de la littérature et les
indices expérimentaux du
produit.
5-3.
SÉPARATIONS CHIRALES EN CPG
Si
on dispose d'un mélange de 2
énantiomères (isomères
optiques) il y a deux techniques pour obtenir une séparation
en CPG, séparation
qui doit permettre une visualisation et un dosage des 2
énantiomères.
5-3-1
Dérivatisation par un agent chiral .
Si
par exemple, on dispose un
mélange de 2 alcools R-OH
énantiomères R et S, on fait réagir
ces
alcools avec du chlorure de 2-phényl
propionyle R, pour obtenir deux esters
diastéréoisomères :C6H5-CH(CH3)-COO-R
(RR et RS).
Ces diastéréoisomères peuvent
être
séparés et dosés sur une colonne
conventionnelle.
5-3-2.
Utilisation d'une phase stationnaire chirale.
Dans ce cas on observe une
interaction différente entre la
phase stationnaire et chaque énantiomère,
d'où une élution différente des
2
isomères optiques.
La phase stationnaire peut être un polymère
siliconé greffé
avec des groupes chiraux (dérivé du camphre par
ex) ou un composé chiral comme
une cyclodextrine peralkylée (OH en O-R ).
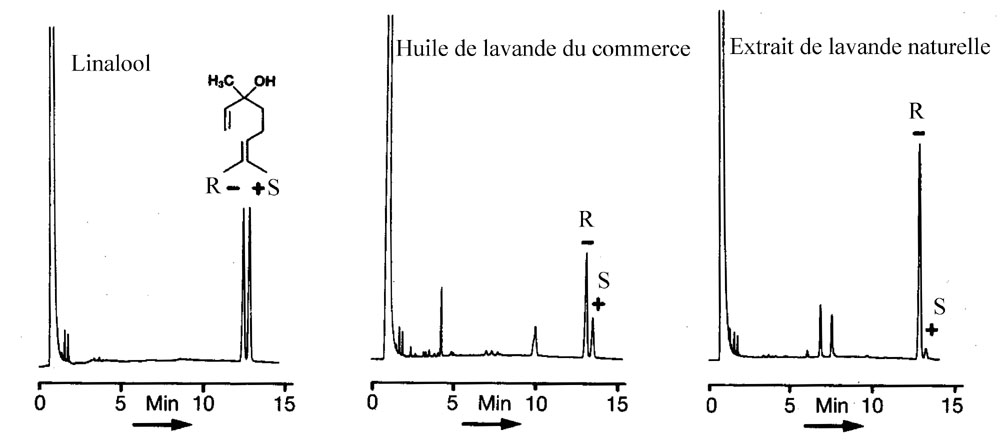 Figure
5-2. Séparation des énantiomères du
linalool [S(+) et R(-)] et
détermination de la composition
énantiomérique de huile de lavande commerciale
et de l'extrait de lavande naturelle sur une colonne capillaire de 25
m
(température 80°C)
imprégnée d'une a
cyclodextrine chirale. [König et coll . J. High
Res. Chromatogr. 13, 328
(1990)]
Figure
5-2. Séparation des énantiomères du
linalool [S(+) et R(-)] et
détermination de la composition
énantiomérique de huile de lavande commerciale
et de l'extrait de lavande naturelle sur une colonne capillaire de 25
m
(température 80°C)
imprégnée d'une a
cyclodextrine chirale. [König et coll . J. High
Res. Chromatogr. 13, 328
(1990)]
Voir
:Etude des énantiomères du linalool
D'après
(eq.3-4), on a :
d (S,R)G°
= -RT ln(a)
= RT ln((trS-tm)/(trR-tm))=
d
(S,R)G°
= -RT ln(a)
= RT ln((trS-tm)/(trR-tm))=
d (S,R)H°
- T
d
(S,R)H°
- T
d (S,R)S°.
(S,R)S°.
Si
on porte sur un graphique Rln(a)
en fonction de 1/T sur un faible domaine de température on
peut déterminer  (S,R)H°
et
(S,R)H°
et  (S,R)S°.
(S,R)S°.
5-3-3
Exercice d'application:
Lors
de la séparation représentée sur la
figure 5-2,
l'énantiomère
R est élué
avant l'énantiomère S. En mesurant les facteurs
de séparation à 2 températures
différentes de la colonne on obtient :
a
= 1,015 à 60°C
et a
= 1,022 à 50°C.
1- Calculer la
différence d'énergie libre de dissolution d(S,R) G°
=
G°
=  (R)G°-
(R)G°- (S)G°
entre les 2 énantiomères.<>
(S)G°
entre les 2 énantiomères.<>
2- Calculer la différence d'enthalpie de dissolution
d(R,S) H°
=
H°
=  (R)H°-
(R)H°- (S)H°
entre les 2 énantiomères
(S)H°
entre les 2 énantiomères
3- Calculer la
différence d'entropie de dissolution d(R,S) S°
=
S°
=  (R)S°-
(R)S°- (S)S°
entre les 2 énantiomères
(S)S°
entre les 2 énantiomères
4- Existe-t’il une température où les 2
énantiomères ne sont
pas séparés ?
Solution.
1-Comme a
est très voisin de 1 on RT(a-1)
=
- d(S,R) G°
G°
d'où d(R,S) G°
=
-323x8.31x0,022= -59 J /mol à 50°C
et d(R,S)
G°
=
-323x8.31x0,022= -59 J /mol à 50°C
et d(R,S) G°
=
- 42 J /mol à 60°C
G°
=
- 42 J /mol à 60°C
2&3-
si on pose x= d(R,S) H°
et y = d(R,S)
H°
et y = d(R,S) S°
,
on a 2 équations :
S°
,
on a 2 équations :
à
60°C
: -42 = x -333y
et
à 50°C
-59 = x -323y,
d'où
on déduit
d(R,S) H°
= -608 J/mol et d(R,S)
H°
= -608 J/mol et d(R,S) S°
= -1,7 unités d'entropie.
S°
= -1,7 unités d'entropie.
4-
On peut remarquer que les termes enthalpique (d(R,S) H°)
et entropique (-T
d(R,S)
H°)
et entropique (-T
d(R,S) S°)
sont de signe opposé, si on
augmente la température, l'écart
d'élution entre les 2 énantiomères va
diminuer, devenir nul à T= 85°C
puis s'inverser (le R sera élué après
le S), lorsque le terme entropique
deviendra prépondérant.
S°)
sont de signe opposé, si on
augmente la température, l'écart
d'élution entre les 2 énantiomères va
diminuer, devenir nul à T= 85°C
puis s'inverser (le R sera élué après
le S), lorsque le terme entropique
deviendra prépondérant.
5-4-
EXEMPLES D'ANALYSE EN CPG
5-4-1
ANALYSES
BIOLOGIQUES
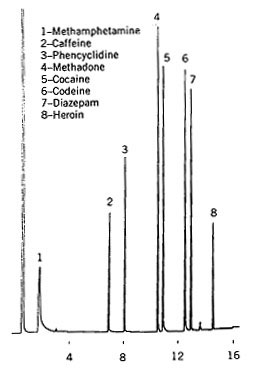 |
Figure
5-3 Chromatogramme d'un mélange de drogues
et substances illégales
Colonne
OV1 12mx0,2mm
Programmation
de température de 140° à
260° à 10°/mn
Le
chromatogramme reproduit ci-contre vient du laboratoire de la "New
Jersey
State Police"
Ces
analyses sont utilisées dans la police scientifique.
l'analyse se fait essentiellement
dans les fluides biologiques (sang, urine) les drogues sont
retrouvées intactes
mais aussi mélangées avec leurs
métabolites
|
5-4-2- ANALYSE POUR L'ENVIRONNEMENT
Le
problème de la pollution de
l'eau par les rejets de l'agriculture va devenir de plus en plus aigu.
Car
l'eau, indispensable à la vie, est au bout de la
chaîne des rejets.
On estime que plus de 1000
produits nouveaux sont introduits sur le marché de
l'agrochimie chaque année et
ces produits se retrouvent inexorablement dans l'eau après
quelques années.
Les herbicides et pesticides
peuvent être aussi dosés à tous les
stades de la chaîne alimentaire (poisson,
légumes...)
La norme CE de 1980 donne les
doses maximum prescrites pour l'eau de consommation: (<0,5 mg/l
de pesticides, <100 mg/l
de CX3H
(X=
F, Cl)...etc.)
Une liste rouge a été établie
pour déterminer les produits les plus dangereux (Hg, Cd, Cr,
DDT, Dioxine...),
et cette liste s'allonge chaque année.
Exemples
d'application de la CPG à l'environnement
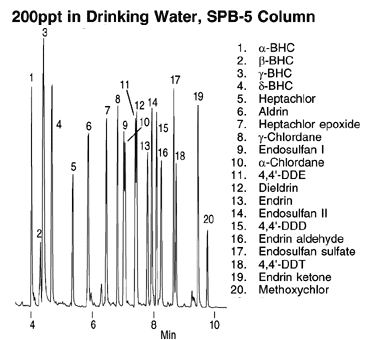 |
Figure
5-4 Chromatogramme d'un
mélange de
pesticides dans de l’eau de consommation.
Conditions
Fibre
SPME: polydimethylsiloxane, film
de 100µm
Extraction par immersion, 15 min (sous forte agitation )
Colonne: SPB-5, 15m x 0.20mm
ID, film de 0,20µm
Four: 120°C
(1 min) à 180°C
à 30°C/min, puis to 290°C
à 10°C/min
phase mobile: hélium, 37cm/sec (à 120°C)
Det.: ECD, 300°C
Inj.: splitless (vanne fermée 3 min), 260°C
|
5-4-2- ANALYSE D'HUILES ESSENTIELLES
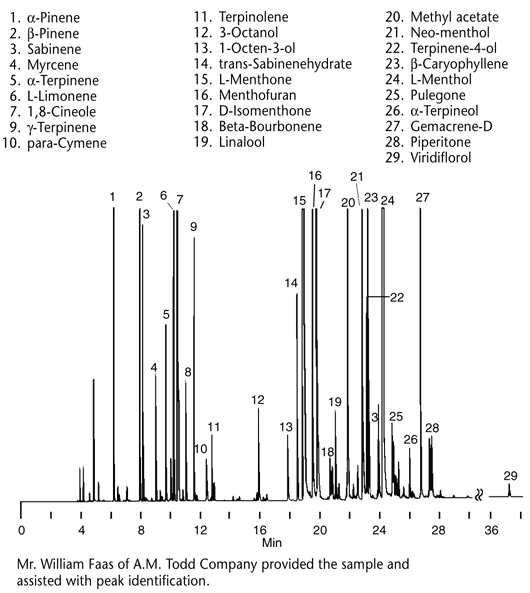 |
Figure
5-5 Chromatogramme de
l'huile essentielle
de menthe.
Conditions
Colonne:
SUPELCOWAX
10,
60m x 0.25mm, film de 0,25µm
Four : 4 min (75°C)
à 200°C
puis 4°C/min, enfin 5 min à 200°C.
Phase mobile: hélium, 25cm/sec (mesuré
à 155°C)
Det.: FID
Inj.: 0.2µL, split (100:1) |

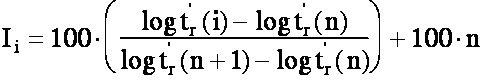 (eq.5-1)
(eq.5-1)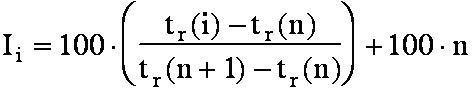 (eq.
5-2)
(eq.
5-2)
 (S,R)G°
= -RT ln(a)
= RT ln((trS-tm)/(trR-tm))=
d
(S,R)G°
= -RT ln(a)
= RT ln((trS-tm)/(trR-tm))=
d (S,R)H°
- T
d
(S,R)H°
- T
d (S,R)S°.
(S,R)S°. (S,R)H°
et
(S,R)H°
et  (S,R)S°.
(S,R)S°. G°
=
G°
=  (R)G°-
(R)G°- (S)G°
entre les 2 énantiomères.<>
(S)G°
entre les 2 énantiomères.<> H°
=
H°
=  (R)H°-
(R)H°- (S)H°
entre les 2 énantiomères
(S)H°
entre les 2 énantiomères S°
=
S°
=  (R)S°-
(R)S°- (S)S°
entre les 2 énantiomères
(S)S°
entre les 2 énantiomères G°
G° G°
=
-323x8.31x0,022= -59 J /mol à
G°
=
-323x8.31x0,022= -59 J /mol à  G°
=
- 42 J /mol à
G°
=
- 42 J /mol à  H°
et y = d(R,S)
H°
et y = d(R,S) S°
,
on a 2 équations :
S°
,
on a 2 équations : H°
= -608 J/mol et d(R,S)
H°
= -608 J/mol et d(R,S) S°
= -1,7 unités d'entropie.
S°
= -1,7 unités d'entropie. H°)
et entropique (-T
d(R,S)
H°)
et entropique (-T
d(R,S) S°)
sont de signe opposé, si on
augmente la température, l'écart
d'élution entre les 2 énantiomères va
diminuer, devenir nul à T=
S°)
sont de signe opposé, si on
augmente la température, l'écart
d'élution entre les 2 énantiomères va
diminuer, devenir nul à T= 