2-1-
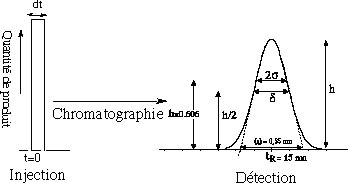
à la sortie de la colonne, il se retrouve déformé suivant une loi statistique approximativement « normale », c'est une courbe de Gauss.
 soit pour le pic :
soit pour le pic : 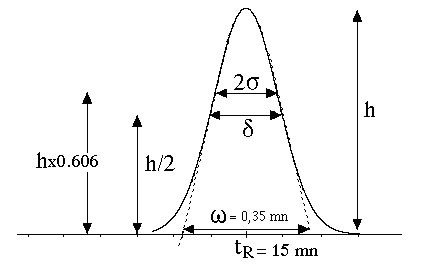
L'équation
mathématique y=f(t) de la courbe de Gauss
est : 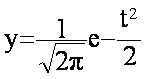
Une
courbe de Gauss est caractérisée par
les
paramètres suivants: (Cf figure 2-1)
2- Variance = s2
3- Largeur à mi-hauteur = d mesurée à h/2. On a la relation: d = 2,35s. (eq.2-1)
4-
la "base" du pic = w.
Cette base est extrapolée par des
tangentes aux deux branches et passant par les points d'inflexion de la
courbe
de Gauss.
On
a la relation:
w
= 4 s
.
(eq.2-2)
2-2
-MODÈLE DES PLATEAUX THÉORIQUES
Ce qui s'est avéré inexact par la suite (les 2 phénomènes sont physiquement différents).
2-2-1 Notion de plateaux théoriques
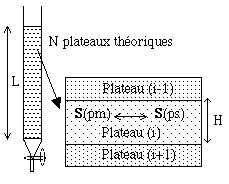
Une colonne de N plateaux théoriques est une colonne divisée en N petits disques cylindriques successifs.
On admet que la phase mobile progresse non pas de façon continue, mais par sauts successifs d'un plateau théorique à l'autre.Dans chaque plateau théorique,
on observe une rétention du soluté S, du fait de l'équilibre de ce produit entre la phase mobile (Spm) et la phase stationnaire (Sps).
Une colonne réelle aura donc "N plateaux théoriques" si elle se comporte comme une "colonne à distiller théorique" de N plateaux.
Dans cette théorie, les pics de chromatographie ont une forme gaussienne et la variance s2 est reliée au nombre de plateaux théoriques N et au temps de rétention tr par la relation:
N augmente donc avec le temps de rétention et diminue si la largeur des pics (s) augmente.
D'après la relation 2-3, une « bonne » colonne de chromatographie qui conduit à des pics fins (s petit) pour des temps de rétention (tr) élevés, est donc caractérisée
par un nombre de plateaux théoriques N élevé..
On peut calculer N en fonction des grandeurs expérimentales de 3 manières différentes:
Formule
(eq.2-4) utilisant la base extrapolée w du pic
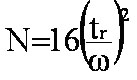 |
Formule
(eq.2-5) utilisant
la largeur à mi hauteur d du
pic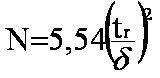 |
Formule
(eq.2-6)
utilisant la hauteur hp
et l'aire A
du pic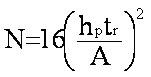 |
L'intérêt de la notion de plateaux théorique est de nous donner une idée de l'efficacité d'une colonne, mais seul l'ordre de grandeur de N est à prendre en compte.
Bien que cette notion de plateaux théoriques soit issue d'une théorie qui s'est avérée inexacte, elle est toujours utilisée car c'est une notion simple et qui bien ancrée dans les habitudes des chromatographistes. Les fabriquants de colonnes donnent toujours dans les spécifications le nombre de plateaux théoriques N pour caractériser l'efficacité de leur colonne.
En CPG, N est donné pour un produit donné, souvent le tridécane (C13H28)
Pour exprimer l'efficacité d'une colonne de longueur L et de N plateaux théoriques, on définit la hauteur H équivalent à un plateau théorique:
H
est appelé la hauteur équivalente à un
plateau théorique
(HEPT), ce paramètre varie entre 10 et
Le tableau suivant montre le pouvoir de séparation des chromatographies les plus utilisées.
| Type de chromatographies |
Nombre de plateaux théoriques N |
N/par mètre de colonne |
H (HETP) en mm |
| CPG
(colonne remplie de |
2000 |
1000 |
1 |
| CPG (colonne capillaire de 25m) | 100000 |
4000 |
0,25 |
| CPL
classique de |
100 |
200 |
5 |
| HPLC
de |
5000 |
50000 |
0,02 |
Exercice d'application 2-1
| Le
chromatogramme de la nicotine a
été obtenu dans les conditions
suivante : Conditions CPG. Colonne remplie 10% Carbowax 20M/2% KOH sur 80/100 Chromosorb W AW 6' (183cm) x 2mm ID . Débit de la phase mobile: 20mL/min. Inj.:1µL Four: 1- Calculer la vitesse linéaire (en cm/sec) de la phase mobile dans la colonne. 2- En déduire le temps mort de cette analyse. 3-Calculer le temps de rétention de la nicotine à 4- Peut-on éluer la nicotine en 1 mn, sachant que la température limite d’utilisation de la colonne et de 250°C ? 5-Le pic de la nicotine a une largeur à mi-hauteur de 10 sec. Calculez N et H. Solution 1- le débit D = V/t = pr2L/t or la vitesse u = L/t d’où u = D/ pr22- tm = L/u soit tm = 183/10,6 = 17,26 sec = 0,29 mn. 3- Pour la nicotine t’r= 2,91 mn à ln(2,91) = A/473 + B et ln(6,31) = A/453 + B. La résolution donne A=8408 et B= -16,7, d'où tr = 15,44 mn à T = 433°K soit 4- à 5- N = 5,54(3,2*60/10)2 = 2042 plateaux théoriques et H = 1830/2521 = |
2-3
-THÉORIE DYNAMIQUE DE LA CHROMATOGRAPHIE
Ce modèle issu de la mécanique des fluides a été mis au point par J.J. Van Deemter. En 1956, ce physicien a mis au point l'équation (eq.2-8) qui relie H (HEPT) aux caractéristiques physiques de la colonne et de la phase mobile.
H = A + B/u + C.u (eq.2-8)
où u est la vitesse de la phase mobile.
Trois facteurs, représentés par les 3 termes de l'équation 2-8, contribuent à l'élargissement des pics2-3-1 Diffusion turbulente. (Terme A)
Suivant la taille et la forme des particules, ils existent pour la phase mobile, plusieurs trajets possibles, cette particularité contribue à l'élargissement des picsLa contribution de A est nulle pour une colonne capillaire de chromatographie en phase gazeuse.
2-3-2- Diffusion longitudinale. (Terme B)
Le
terme B/u
traduit la dispersion du soluté à cause de la
diffusion du soluté dans la colonne.
et Dm est le coefficient de diffusion du soluté dans la phase mobile.
Le terme B/u est évidemment inversement proportionnel à u. L'efficacité d'une colonne augmente avec la vitesse de la phase mobile.Ceci peut expliquer les bonnes séparations obtenues en HPLC; de plus, comme le terme Dm est environ 5 fois plus grand en CPG qu'en CPL, il en résulte que la contribution de la diffusion longitudinale est presque négligeable en HPLC.
2-3-3- Résistance au transfert de masse.(Terme C)
Ce terme C*u représente la résistance au transfert du soluté entre les phases mobiles et stationnaires, cette résistance empêche l'établissement de l'équilibre entre S(pm) et S(ps). Ce phénomène est du par exemple au fait que certaines molécules stagnent dans les pores de la phase stationnaire.Plus la vitesse (u) de la phase mobile diminue, plus les molécules de soluté peuvent pénétrer dans la phase stationnaire, plus l'équilibre entre les 2 phases est favorisé et plus la colonne est performante.
Le terme C est proportionnel à (dp2/Dm), les colonnes les plus efficaces seront celles régulièrement remplies et bien tassées où le diamètre des particules est le plus faible possible. Il faut également utiliser des solvants de faible viscosité pour minimiser ce terme
2-3-4- Courbe de Van Deemter
La représentation graphique de l'équation (eq.2-8) est appelée courbe de Van Deemter
On peut tirer un résultat important de cette courbe, c'est l'existence d'un débit optimal de phase mobile pour lequel l'efficacité de la colonne est maximum (HEPT minimum).
Réduire le débit de la phase mobile en deçà de ce débit optimal peut diminuer fortement le pouvoir séparatif d'une colonne, surtout en CPG où la contribution du terme B/u est importante
Contrairement à
Ils existent d'autres formulations de l'équation de Van Deemter plus adaptées à la HPLC .
Exemple de courbe de Van Deemter expérimentale : Exercice d'application 2-2
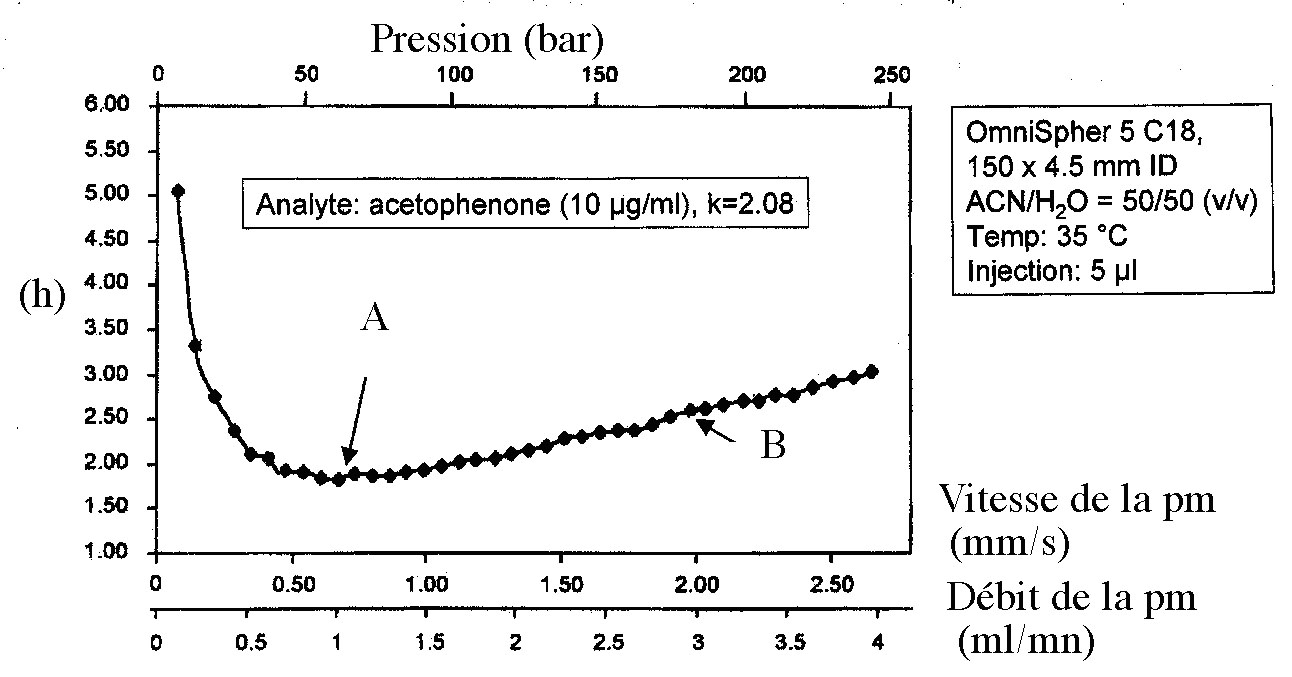
Soit une
courbe de V.D. expérimentale, obtenue en HPLC, [ Int
.Lab 30,
20 (2000)]; en ordonnée est reportée la hauteur
de plateau
réduite
h =
H/dp
(où dp =
5 mm
est le diamètre des particules. On
considère deux points particuliers A et B sur cette courbe.
1- Au
point A
(débit = 1 ml/mn, U = 0,65 mm/s et h = 2), calculer le
temps mort et le temps d'analyse.
2-
Même question au point B (débit = 2,75 ml/mn, U =
1,7 mm/s et h =
2,5).
Solution:
1- tm = L/u soit 230 s = 3,83 mn; tA = tm(1+k') = 708 s = 11,80 mn
2- tm = 88,23 s = 1,.47 mn; tB = 271,76s = 4,5 mn
3- NB/NA = hA/hB = 0,.8 . En conclusion, N diminue un peu car il est multiplié par 0,8 mais le temps d'analyse diminue énormément car il est divisé par 2,6.Il peut donc s'avérer plus "rentable" de faire l'analyse au point B qu'au point A.