Figure 1-1: Séparations entre 2 pics en chromatographie
|
COURS DE CHROMATOGRAPHIE
(Master de Chimie 1ère année) Faculté des
Sciences d'Orsay
- Généralités
sur la chromatographie
- Théorie de la chromatographie 1 - Comment
améliorer une séparation en chromatographie
- Théorie
de la chromatographie
2- Paramètres caractérisant la rétention - Temps et volume
de rétention
- Interprétation thermodynamique des
paramètres de rétention- Temps et volume morts - Temps et volume de rétention réduits - Le facteur de rétention - La constante
d'équilibre (ou de partition)
- Exercices d'application- Le facteur de rétention - Le temps de rétention - Influence de la température sur les temps de rétention réduits - Théorie de la chromatographie 3 - La chromatographie en phase gazeuse (CPG) - Analyse en chromatographie en phase gazeuse - Optimisation d'une analyse - Glossaire |
THÉORIE
DE
1-1
–
COMMENT AMÉLIORER UNE SÉPARATION
EN CHROMATOGRAPHIE ?
Il y a deux possibilités pour améliorer la séparation entre les 2 pics du chromatogramme (a) :
1- A largeur de pic constante, on peut augmenter la différence de temps de rétention entre les 2 pics, ceci est illustré dans chromatogramme (b)
2- A temps de rétention constant, on peut diminuer la largeur des pics, le chromatogramme (c) illustre ce phénomène.
En pratique, on peut jouer à la fois sur ces 2 paramètres pour améliorer une séparation.
En conclusion, deux paramètres s'avèrent donc primordiaux en chromatographie, la rétention et la forme du pic.
1-2-
PARAMÈTRES CARACTÉRISANT
|
Le chromatogramme du Prozac (antidépresseur) a été enregistré dans les conditions suivantes : HPLC. Colonne C18: 15cm x 4.6mmPhase mobile: acetonitrile / 25mM KH2PO4 pH 7.0 (40:60) Débit: 2mL/min. Température: Détecteur UV : 254 nm . Injection: 1µL |
Figure 1-2: Chromatogramme du Prozac |
1-2-1- Le temps de rétention.
Le
temps de rétention tr
d'un produit S
est le temps écoulé
entre le début de l'injection et la sortie du produit. (pour
le chromatogramme 2, tr
= 3mn)
tr dépend du produit S et des conditions expérimentales (colonne, température, débit de phase mobile... etc.)
1-2-2- Le volume de rétention
Le
volume de rétention Vr
correspond au volume de phase
mobile nécessaire pour éluer le produit S.
Si D
est le débit de la phase mobile
(D
supposé constant) :
Le
temps mort tm
est
le temps que met la phase mobile pour traverser la colonne.
(dans la figure 2, tm
= 1mn)
u = L / tm (pour le chromatogramme 2, u = 15 cm/mn)
En CPG, le temps mort correspond au temps de rétention de substances non retenue par la phase stationnaire comme l'air ou le méthane.1-2-4- Le volume mort.
On appelle volume mort Vm le volume de phase mobile qui passe à travers la colonne pour aller d'une extrémité à l'autre de la colonne (pendant le temps tm). Autrement dit, Vm est le volume occupé par la phase mobile dans une colonne.
Vm = tm * D. (pour le chromatogramme 2,Vm = 1*2 = 2 ml)
Vm ne dépend que de la géométrie et du remplissage de la colonne.
1-2-5- Volume et temps de rétention réduits
On appelle volume de rétention réduit V'r, la différence entre les termes Vr et Vm.
V'r = Vr - Vm (eq.1-1) (pour le chromatogramme 2, V'r = 4 ml)
Le volume de rétention réduit correspondant au produit S est le volume de phase mobile qui doit passer à travers la colonne pour éluer le composé S.
De la même façon, on définit un temps de rétention réduit t'r.
t'r = tr - tm (eq.1-2) (pour le chromatogramme 2, t'r = 2 mn)
Les volumes et temps de rétention réduits sont indépendantes des volumes et temps morts, elles dépendent donc moins de l'instrumentation (de la colonne).
1-2-6- Le facteur de rétention (ou de capacité).
Le facteur de rétention k' pour un produit donné est défini comme suit :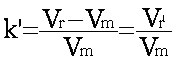 ou
également
ou
également 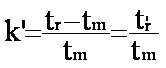 (eq.1-3)
(eq.1-3)
Ce qui donne : Vr = Vm(1 + k’) et tr = tm(1 + k’) ((eq.1-4)
Les facteurs de rétention sont des grandeurs sans dimension donc plus générales d'un produit donné que les temps ou les volumes de rétention réduits. (pour le chromatogramme 2, k' = 2)
D'où une définition du facteur de rétention d'après (eq.1-3) : c'est le rapport du temps passé par le soluté dans la phase stationnaire sur le temps passé par ce même soluté dans la phase mobile.
1-3- INTERPRÉTATION THERMODYNAMIQUE DES PARAMÈTRES DE RÉTENTION
1-3-1-
La constante d'équilibre (ou constante de partition) K
Le problème est le suivant: trouver les relations entre les paramètres de rétention (Vr, k', tr' et tr) et la constante d'équilibre K caractérisant l'équilibre suivant:
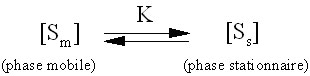
L'élution
d'un soluté S
en chromatographie est donc caractérisé
par la constante d'équilibre K,
appelée aussi constante de partition.
ms = masse du soluté S dissous dans la phase stationnaire
Vm = volume de la phase mobile (équivalent au volume mort)
Vs = volume de la phase stationnaire
Vm et Vs sont constants pour une colonne donnée avec une phase stationnaire donnée ( b= Vm/Vs).
Le
paramètre b,
appelé rapport de phases est une constante qui
caractérise une colonne de chromatographie.
b sera calculé par la suite pour une colonne capillaire en chromatographie en phase gazeuse.
La
relation (eq.1-5) devient
: 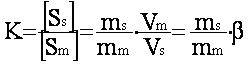 (eq.1-6)
(eq.1-6)
1-3-2-
Le facteur de rétention k'
D'après
(eq.1-3),
on déduit
que
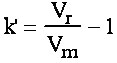
Si on suppose que Vr est proportionnel à la masse totale de soluté dissous dans la phase stationnaire et dans la phase mobile.
On a
donc Vr
proportionnel
à ( ms
+
mm )
De la même façon, si on suppose que Vm est proportionnel à la masse de soluté dissous dans la phase mobile.
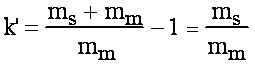 et d'après eq.1-6 on a donc
et d'après eq.1-6 on a donc 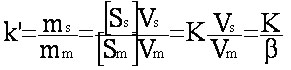
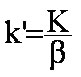 (eq.1-7)
(eq.1-7) 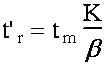 et
et
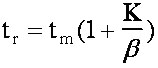 (eq.1-8)
(eq.1-8)
La
dernière expression est cohérente, si un produit
n'a
aucune affinité avec la phase stationnaire : [Ss]
=
0 donc K
= 0 et tr
=
tm
. Ceci est le cas de l'air ou en première
approximation du CH4
en CPG, ce qui permet la mesure du temps mort.
1-3-4- Influence de la température sur les temps de rétention réduits tr'
K
varie avec la température T suivant l'équation
classique
(eq.1-9), où  G°
est la
différence d'énergie libre de dissolution du
soluté S
entre les 2 phases. K
est
>>1 donc
G°
est la
différence d'énergie libre de dissolution du
soluté S
entre les 2 phases. K
est
>>1 donc  G°
est
négative.
G°
est
négative.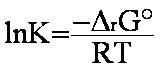 (eq.1-9)
(eq.1-9)
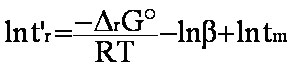 (eq.1-10)
(eq.1-10)
 G°
est la différence d'énergie libre de dissolution
du soluté entre
les phases mobile et stationnaire.
G°
est la différence d'énergie libre de dissolution
du soluté entre
les phases mobile et stationnaire.

Plus  G°(dissol
pm→
ps)
est petit (grand en valeur absolue), plus la constante
d'équilibre K
est
grande, plus le produit est retenu sur la colonne, plus le tr
est grand.
G°(dissol
pm→
ps)
est petit (grand en valeur absolue), plus la constante
d'équilibre K
est
grande, plus le produit est retenu sur la colonne, plus le tr
est grand.
D’après la figure 1-3, il apparaît que pour avoir une séparation chromatographique, il faut que :
 G°(dissol
pm→
ps) <0 soit
G°(dissol
pm→
ps) <0 soit  G°(dissol
ps)
<
G°(dissol
ps)
< G°(dissol
pm) ou
en valeur absolue
G°(dissol
pm) ou
en valeur absolue  G°(dissol
ps)
>
G°(dissol
ps)
>  G°(dissol
pm)
G°(dissol
pm)
 G°(dissol
pm→
ps) est
fonction de la température, en effet
G°(dissol
pm→
ps) est
fonction de la température, en effet  G°
=
G°
=  H°
- T*
H°
- T* S°
.
S°
.
Si
l'on suppose que  H°
et
H°
et  S°
sont indépendants de la
température, la formule (eq.1-10) devient
S°
sont indépendants de la
température, la formule (eq.1-10) devient
ln
tr'
= - H°/RT
+
H°/RT
+  S°/R
- ln
b+ ln tm
S°/R
- ln
b+ ln tm
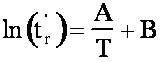 (eq.1-11)
(eq.1-11)où A et B sont des constantes pour un produit donné et une colonne donnée.
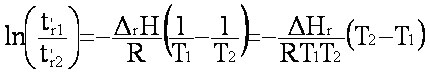 (eq. 1-12)
(eq. 1-12)comme
t'r1>t'r2,
on voit que  H°
est toujours <0.
H°
est toujours <0.
Le
temps mort tm,
peut être supposé indépendant
de la température
pour une colonne donnée et une
pression donnée.
En
réalité, lorsque la température
augmente, le mouvement brownien augmente, la viscosité de la
phase mobile (gaz) augmente et sa
vitesse diminue légèrement dans la direction de
la colonne. On observe expérimentalement une faible
augmentation du temps mort avec la température.
1-4-
EXERCICES D'APPLICATION
Exercice
1-4-1
Les paramètres
thermodynamiques des produits suivants ont
été mesurés sur une colonne capillaire
ayant pour phase stationnaire un
polysiloxane.
Les
termes  H°
et
H°
et  S°
correspondent aux variations
d'enthalpie et d'entropie de dissolution des produits entre la
phase gazeuse et la phase stationnaire.
S°
correspondent aux variations
d'enthalpie et d'entropie de dissolution des produits entre la
phase gazeuse et la phase stationnaire.
Quelle sera
l'ordre d'élution de ces produits à
| Décane |
Butyl
acétate |
1-Heptanol |
1-Bromobutane |
Hexyl
acétate |
|
 H°
Kj/mol H°
Kj/mol |
-47,2 |
-34 |
-36.9 |
-31 |
-42 |
 S°
en u.e. S°
en u.e. |
-75.4 |
-58 |
-58 |
-51 |
-66 |
On
a  G°
=
G°
=  H°
-T
H°
-T S°
, plus
S°
, plus  G°
est petit (grand en
valeur absolue) plus le produit est retenu sur la colonne. A
G°
est petit (grand en
valeur absolue) plus le produit est retenu sur la colonne. A
| Décane |
Butyl
acétate |
1-Heptanol |
1-Bromobutane |
Hexyl
acétate |
 G°
Kj/mol G°
Kj/mol |
-.17,5 |
-11,2 |
-14.1 |
-10.96 |
-16,06 |
| Ordre
d'élution |
5 |
2 |
3 |
1 |
4 |
|
Le chromatogramme de la nicotine a été obtenu dans les conditions suivantes : CPG. Colonne rempliePhase stationnaire: 10% Carbowax 20M/2% KOH sur 80/100 Chromosorb W AW Dimensions de la colonne: Longueur 6' (183cm) x 2mm (diamètre intérieur) Débit de la phase mobile: 20mL/min. Quantité injectée:1µL Four: Four: Questions : 1- Calculer la vitesse linéaire (en cm/sec) de la phase mobile dans la colonne. 2- En déduire le temps mort de cette analyse. 3-Calculer
le temps de rétention de la nicotine à |
1- le débit D = V/t = pr2L/t or la vitesse u = L/t d’où u = D/pr2
Application numérique : u = 20//p(0,1)2 soit 636 cm/min ou 10,6 cm/sec
2- tm = L/u soit tm = 183/10,6 = 17,26 sec = 0,29 mn.
3-
Pour la nicotine t’r= 2,91 mn à
l'expression (eq.1-11) conduit à 2 équations avec 2 inconnues.
ln(2,91) = A/473 + B et ln(6,31) = A/453 + B
La
résolution donne A=8408 et B= -16,7, d'où tr =
15,44 mn à
T = 433°K soit
4- A
On peut donc éluer la nicotine en 1 mn en
étant à une température inférieure à
la température limite d'utilisation de la colonne (250°C)